
O Mercado Brasileiro é visto por muitas empresas de produtos médicos, como um mercado cheio de possibilidades, porém pode causar espanto devido as particularidades e burocracias que muitas vezes as empresas encontram.
Considerando que a ANVISA (Agência Nacional de Vigilância Sanitária) é uma agência muito bem estruturada, porém relativamente nova em relação ao FDA, por exemplo, a dinâmica e velocidade com que novos regulamentos e ajustes ocorrem, torna complexo o entendimento por empresas estrangeiras em relação ao melhor caminho para aprovar seus produtos. Muitas vezes, criando barreiras e resistências para trazer os produtos ao Brasil por entendimentos equivocados e até obsoletos, uma vez que tem havido esforços significativos no sentido de harmonização e simplificação de alguns procedimentos.
Nos últimos anos, a ANVISA tem sido um dos órgãos reguladores mais atuantes em iniciativas internacionais de harmonização de normas regulatórias, como o Fórum Internacional de Reguladores de Dispositivos Médicos, o IMDRF e o programa de Auditoria Única de Dispositivos Médicos, o MDSAP como uma substituição para auditorias in loco, que efetivamente encerrou a etapa mais demorada no registro dos produtos de risco III e IV e a obtenção de Certificação de Boas Práticas obrigatória para os registros destas categorias.
O Programa de Auditoria única em Produtos para saúde – MDSAP, busca a convergência regulatória, promovendo, a longo prazo, maior alinhamento global das abordagens regulatórias baseados em padrões internacionais de Boas Práticas e regulação sanitária mais efetiva e eficiente. O programa tem o objetivo de permitir uma única auditoria com foco na ISO 13485 e itens específicos das entidades reguladoras de cada país, para satisfazer os requisitos regulatórios dos participantes, o que consequentemente, gera maior confiança em seus resultados.
Uma outra característica do programa MDSAP é a celeridade de renovações de Boas Práticas de Fabricação, onde em sua maioria, as empresas conseguem a renovação do certificado através de análise documental e consequentemente, podem obter o registro e comercialização dos produtos de forma muito mais ágil.
Veja como a obtenção do Certificado MDSAP pode ajudar a sua empresa.
As etapas destacadas em vermelho não são necessárias para os participantes do programa MDSAP, o que pode reduzir o prazo de obtenção do certificado em relação ao procedimento convencional.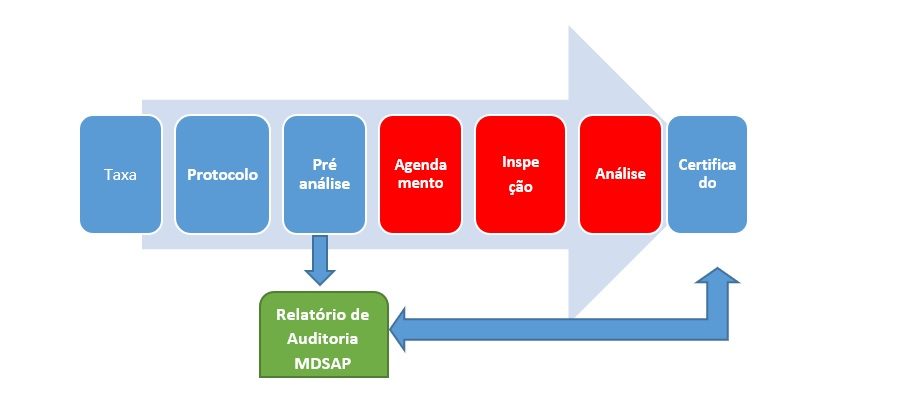
A Anvisa também estuda com veemência aumentar o prazo de validade da certificação de Boas Práticas de Fabricação internacional, de 2 para 4 anos, para os participantes do programa MDSAP, o que é bastante interessante como perspectiva de redução futura de custos de manutenção dos registros.
Desta forma, o certificado via MDSAP se destaca como um dos principais facilitadores atualmente para a obtenção do certificado de Boas Práticas.
Obviamente, para o sucesso do projeto serão necessários outros fatores, como estudos clínicos adequados e testes de eficácia e segurança em conformidade com os requisitos da legislação, por exemplo.
Por fim, cabe a cada empresa definir suas próprias estratégias, mas um dos principais motivos de sucesso no mercado brasileiro de produtos para saúde pode ser um fator externo: uma parceria sólida com quem conhece o caminho para contornar todas as adversidades que esse diversificado mercado exige e nós da Equipe Vera Rosas sabemos o caminho certo e estamos prontos para te ajudar.
Todo o conteúdo foi elaborado e cedido por nossa parceira Vera Rosas Registro e Legalização.
www.verarosas.com.br